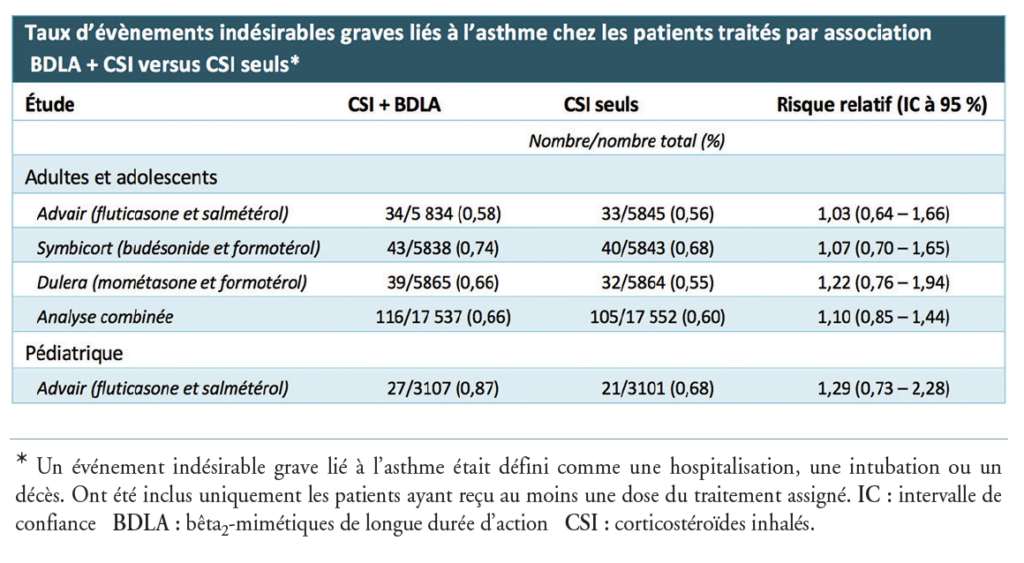
Association bêta-2-mimétiques et corticostéroïdes inhalés : pas de risque augmenté
On se souvient que les bêta-2-mimétiques à longue durée d’action (LABA) ont longtemps été soupçonnés d’entraîner une mortalité accrue chez les asthmatiques traités. À tel point qu’en 2010, la Food and Drug Administration (FDA) américaine a mandaté les principaux producteurs de LABA à réaliser des études de sûreté comme le rappelle la Revue médicale suisse.1 L’heure est au recul avec des résultats rassurants synthétisés par Horisberger, et al. Quatre études ont ainsi comparé un traitement combiné de corticostéroïdes inhalés (ICS) 1 LABA à un traitement d’ICS seuls. Les quelque 36 000 participants souffraient d’un asthme modéré à sévère, pour lequel la grande majorité avait déjà reçu des corticostéroïdes systémiques. Les résultats de ces études aux méthodes harmonisées ont fait l’objet d’une évaluation par une commission indépendante. Les événements sévères liés à l’asthme (hospitalisation, intubation et/ou décès) ne différaient pas entre les deux groupes et les cas de décès se sont avérés exceptionnels.
Les patients sous traitement combiné ont présenté moins d’épisodes d’exacerbations (diminution du risque relatif de 17 %). Deux autres études ont comparé un traitement par ICS 1 LABA pris à la demande au traitement par ICS en continu dans l’asthme modéré. Concernant le contrôle des symptômes d’asthme au quotidien, le traitement d’ICS 1 LABA pris à la demande a démontré un léger bénéfice par rapport à un traitement de bêta-2-mimétique à courte durée d’action à la demande, la première modalité restant néanmoins un traitement d’ICS en continu. La réduction du risque d’exacerbations asthmatiques est par contre du même ordre entre le traitement combiné à la demande et celui par ICS en continu. Cela a été confirmé par une autre étude indépendante. Dans ces deux études, le taux d’exacerbations sous traitement d’inhalation maximal était de 10 %. Sur la base de ces études, les auteurs déduisent que la combinaison ICS 1 LABA n’est pas associée à un risque augmenté de complications graves par rapport au traitement d’ICS en continu. Aussi peut-elle être envisagée comme traitement à la demande chez les patients souffrant d’un asthme modéré.
En pratique, les patients doivent être informés du risque d’anévrisme et de dissection aortique. Ils doivent être avertis de la nécessité d’une prise en charge immédiate par un médecin au sein d’un service d’urgence en cas d’apparition brutale d’une douleur intense abdominale, thoracique ou dorsale.
InfoRespiration N°149 – Février 2019
Association bêta-2-mimétiques et corticostéroïdes inhalés : pas de risque augmenté Lire la suite »