The two extremes of cardiac sarcoidosis and the effect of prednisone therapy
D Armstrong et al.
American Journal of cardiology 2015, [Epub ahead of print]
Morphologic features of cardiac sarcoidosis in native hearts of patients having cardiac transplantation
W Roberts et al.
American Journal of cardiology 2014 Feb 15;113(4):706-12.
Par le Docteur Jean-Herlé RAPHALEN et le Docteur Fleur COHEN AUBART (Service de Médecine Interne, Institut E3M, Hôpital Pitié-Salpêtrière, Paris)
Danielle Amstrong et al. décrivent l’examen anatomo-pathologique de deux cœurs explantés pour une greffe, un homme et une femme dans leur cinquième décade, tous les deux transplantés sur des cardiopathies dilatées à coronaires saines.
Chez l’homme, un diagnostic de sarcoïdose avait été porté 21 mois avant la transplantation sur une biopsie d’adénopathie médiastinale et il avait été traité par corticothérapie générale. L’examen histologique du cœur montrait de larges cicatrices fibreuses mais pas de granulome.
L’examen histologique du cœur de la femme présentait, en plus des cicatrices fibreuses, de multiples granulomes épithélioïdes. Chez elle, le diagnostic de sarcoïdose n’avait pas été porté avant la transplantation et elle n’avait pas reçu de corticothérapie.
On retrouvait chez les deux patients une atteinte diffuse de toutes les parois ventriculaires, libre et septale, l’atteinte auriculaire n’étant pas mentionnée (une partie importante étant conservée chez le receveur pour la greffe).
Les auteurs discutaient le fait que le traitement par prednisone chez l’homme avait permis d’éradiquer les granulomes mais n’avait pas eu d’impact sur l’évolution vers les cicatrices fibreuses.
William C Roberts et al. décrivent les caractéristiques cliniques et l’examen anatomo-pathologique de 10 patients transplantés cardiaques entre 1993 et 2013 à l’hôpital universitaire de Dallas chez qui le diagnostic final de sarcoïdose cardiaque était retenu. Cela représentait 3% des transplantations cardiaques de l’hôpital. La densité de granulome et de fibrose était graduée de 0 à 4 sur les dix explants.
Le diagnostic de sarcoïdose cardiaque n’était porté avant la transplantation que chez 2 patients ayant eu un prélèvement myocardique systématique lors de la pose d’une assistance orthotopique. Chez les 8 autres, la découverte de granulome était faite sur l’explant cardiaque.
Il s’agissait de patients âgés de 38 à 55 ans, 6 femmes pour 4 hommes, ayant des signes d’insuffisance cardiaque depuis 1 à 15 ans. Les patients présentaient tous une dysfonction systolique (FeVG entre 10 et 20%) avec des dilatations ventriculaires marquées allant de 5 à 9 cm pour le VG et de 2 à 9 cm pour le VD.
Les électrocardiogrammes lorsqu’ils avaient pu être enregistrés avant un éventuel appareillage montraient un bloc de branche dans 4 cas sur 5.
L’examen macroscopique des cœurs révélait des cicatrices fibreuses sur toutes les parois myocardiques (VD, VG et septum), transmurale le plus souvent, surtout pour la paroi libre du VD. L’atteinte sous épicardique isolée était possible. L’atteinte auriculaire n’est pas évidente du fait de la conservation quasi complète pour la transplantation. Aucun des cœurs ne présentait d’atteinte macroscopique des artères coronaires.
La densité de granulome et de fibrose était très variable et non corrélée ni inversement corrélée. Aucun granulome n’était trouvé sur le tissu valvulaire, coronarien ou épicardique.
Au total, ces deux articles nous rappellent que la sarcoïdose est une cause de cardiopathie dilatée à coronaires saines sévère et que les manifestations extracardiaques peuvent être discrètes. Le diagnostic peut donc être porté tardivement (y compris après la transplantation) s’il n’est pas recherché spécifiquement.
La topographie de l’atteinte myocardique n’est pas spécifique puisque qu’elle peut toucher toutes les parois du myocarde, de façon transmurale ou non. Il faut donc probablement l’évoquer pour toute cardiopathie dilatée sans cause définie.
Ces articles ne détaillent pas d’éventuels examens d’imagerie antérieurs à la transplantation (IRM, PET scanner) et ne peuvent donc pas servir d’aide à la difficile corrélation radiologico-histologique.
D Armstrong et al. rappellent par ailleurs que si la corticothérapie est probablement efficace pour faire disparaître les granulomes, son bénéfice sur le long terme, en particulier lorsqu’il existe une dysfonction ventriculaire gauche établie, reste non démontré.
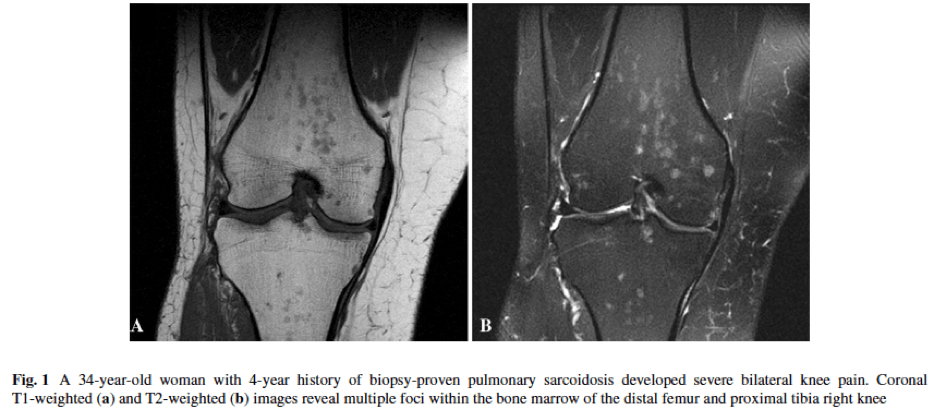
[hr] Osseous sarcoidosis: a case seriesKuzyshyn H, Feinstein D, Kolasinski SL, Eid H. Rheumatol Int. 2014 Nov 2. [Epub ahead of print]
Par le Docteur BITOUN et le Docteur COHEN AUBART, Service de médecine interne, Institut E3M, Hôpital Pitié-Salpêtrière
La fréquence des atteintes osseuses de la sarcoïdose varie de 3 à 39% selon la population étudiée et la modalité d’imagerie utilisée. Classiquement l’atteinte prédomine aux mains et aux pieds sous forme de lésion lytiques à la radiographie standard. Cependant la signification des lésions décrites à l’IRM et au scanner et leur prise en charge thérapeutique restent mal codifiées. Cette étude décrit 5 cas de sarcoïdose multi-systémique avec atteinte osseuse y compris des vertèbres et des os longs ainsi que leur prise en charge thérapeutique.
L’IRM osseuse a été réalisée sur point d’appel clinique dans 4 cas sur 5 conduisant à identifier des lésions. Elles étaient vertébrales dans 3 cas, sur les os long dans un cas et touchait les deux dans un autre cas. Une atteinte pulmonaire a pu être mise en évidence chez 4 patients. Chez 2 patients un traitement par méthotrexate et corticoïdes a permis de faire régresser les douleurs. L’utilisation d’anti-TNF alpha dans un cas s’est traduite par la régression des images radiographiques.
Au total, l’atteinte des os longs et des vertèbres est possible dans la sarcoïdose. Cependant la modalité d’imagerie optimale pour le diagnostic et le suivi des sarcoïdoses osseuses reste à définir. D’autres études sont nécessaires pour optimiser la prise en charge de ce type d’atteinte.
[hr]
Blau syndrome: cross sectionnal data from a multicentre study of clinical, radiological and functional outcome
Carlos D. Rosé et al.
Rheumatology, 2014 Nov 20 [Epub ahead of print]
Par le Docteur Loïc DURON et le Docteur Fleur COHEN AUBART (Service de Médecine Interne, Institut E3M, Hôpital Pitié-Salpêtrière, Paris)
Le syndrome de Blau est un syndrome auto-inflammatoire systémique monogénique de transmission autosomique dominante résultant de mutations dans la région CARD15 du gène NOD2 et associant des signes cutanés, oculaires et articulaires. Cette publication rapporte les résultats de première visite d’un suivi de cohorte international mené pour clarifier l’histoire du syndrome de Blau.
Les 31 patients inclus présentaient des mutations de NOD 2 et se répartissaient en 12 femmes et 19 hommes, dans 18 centres issus de 11 pays, avec 18 enfants et 13 adultes ayant un âge médian à l’évaluation de 16,5 ans (extrêmes 1,9-58). L’âge médian au début des symptômes articulaires était de 2 ans (de 3 mois à 13 ans), ophtalmologiques de 4,4 ans (de 6 mois à 22 ans), cutanés de 1,1 an (de 2 mois à 20 ans).
Vingt-cinq patients présentaient une atteinte cutanée, à prédominance érythémato-papuleuse, avec comme deuxième manifestation la plus fréquente l’érythème noueux. Un cas de vascularite leucocytoclasique était décrit.
Trente patients avaient des manifestations articulaires, à début oligo-articulaire (n=7) ou poly-articulaire (n=23). Les articulations les plus touchées étaient les poignets (87%), les genoux (73%), les chevilles (63%), les IPP (53%), les MCP et/ou les coudes (33%). En revanche, les hanches (9%), le rachis (6%) et les ATM (3%) étaient rarement atteints. Il y avait des déformations dans 53% des cas, touchant en moyenne 8 articulations (IQR 8), essentiellement les IPP avec camptodactylie dans 19 cas.
Vingt-cinq patients présentaient une atteinte oculaire, bilatérale dans 24 cas (96%). Il s’agissait d’une uvéite antérieure (100%), d’une atteinte postérieure (72%) ou d’une uvéite intermédiaire (52%).
Les principales autres atteintes du syndrome de Blau (présentes dans 48% des cas) comprenaient des adénopathies, une hépatosplénomégalie, une fièvre récurrente, des signes de vascularite, des pneumopathies infiltrantes diffuses, des néphrites interstitielles et des paralysies faciales transitoires.
Trente patients bénéficiaient de traitements par voie générale, dont 70% recevaient une combinaison de corticoïdes et d’immunosuppresseurs ou un traitement biologique. Malgré le traitement, 70% des patients gardaient des arthrites actives, 61% une inflammation vitréenne, 35% une uvéite antérieure. Les anti-TNF alpha étaient les traitements biologiques les plus utilisés.
Au total, cette cohorte de grande ampleur a permis de caractériser les manifestations et le suivi des patients atteints de syndrome de BLAU. Les auteurs montrent qu’il s’agit d’une maladie chronique fréquemment associée à une morbidité oculaire (baisse d’acuité visuelle chez 1/3 des patients) et articulaires (fréquentes déformations) et une qualité de vie altérée. La persistance d’une activité inflammatoire articulaire ou ophtalmologique après 10 ans d’évolution est fréquente. Les auteurs décrivent par ailleurs des anomalies radiographiques osseuses précédemment non décrites (dysplasie des os du carpe en particulier) et suggèrent un rôle de NOD 2 dans l’ostéogénèse. Enfin, la persistance d’une activité inflammatoire après des années d’évolution rappelle le caractère fréquemment résistant de cette affection aux traitements classiques et l’utilisation possible des antiTNF alpha.
[hr]Mathematical model of sarcoidosis
W Hao et al. PNAS 2014; Nov11 Vol 111(45) :16065-16070
Par le Docteur Fleur COHEN AUBART, Service de Médecine Interne, Institut E3M, Hôpital Pitié-Salpêtrière, Paris
Dans cet article du PNAS, les auteurs proposent un modèle mathématique permettant de décrire l’évolution de la taille des granulomes de la sarcoidose dans leur histoire « naturelle » et après administration de divers traitement (antiTNF alpha, antiIL12, anti IFN gamma et activation du TGF beta).
Pour cela, ils partent d’un schéma théorique articulant les cellules impliquées dans la formation du granulome (macrophage activé, lymphocytes Th1, Trég et TH17), des cyotkines (IFN gamma, IL2, 10, 12, 13, TNF alpha et TGF beta), une chimiokine (GM-CSF) et un facteur de croissance (GM-CSF). Des équations sont construites représentant ces diverses interactions sous forme de production (ou activation), inhibition et chémo-attraction.
Les auteurs assument le fait qu’un granulome occupe une région dans laquelle des macrophages et des lymphocytes T sont en mouvement avec une vitesse u et que tous les éléments du granulome se dispersent ou diffusent avec des coefficients de dispersion variables et estimés par une équation pour chaque élément. Le granulome est considéré comme une sphère de rayon r dans laquelle tous les éléments sont symétriques.
Les auteurs utilisent des données sur les dosages de cytokines dans des poumons sains et valident leur modèle avec les résultats de ces dosages obtenus sur des poumons de patients ayant une sarcoidose, avec une très bonne corrélation. Les auteurs partent du fait que la maladie commence avec l’activation du macrophage et simulent la croissance d’un granulome initialement de rayon 0.1 cm à T0 et de 0.13 cm à T100. Inversement, sous traitement, ils considèrent comme complète guérison le retour à un rayon de 0.1cm et estiment l’évolution de ce rayon après traitement en estimant le dosage des cytokines après biothérapie antiTNF alpha, antiIL12, anti IFN gamma et activation du TGF beta.
Au total, dans cet article, les auteurs décrivent un modèle mathématique original permettant de décrire l’évolution naturelle et sous traitement de la taille des granulomes. Ils expliquent que ce modèle pourrait permettre de tester l’effet de nouvelles biothérapies ciblées sur telle ou telle cytokine. Le modèle pourrait être ultérieurement affiné par de nouvelles données physiopathologiques et la connaissance d’effets indésirables des traitements.
Cet article est ainsi le premier à modéliser de façon mathématique la croissance du granulome dans la sarcoidose. L’évolution sur le long terme et en particulier la régression spontanée dans la grande majorité des cas de ceux-ci n’est pas explicitée. Enfin, la prise en compte de l’évolution vers la cicatrice fibreuse n’est pas réalisée, celle-ci étant probablement plus importante que la disparition du granulome per se. Il s’agit malgré tout d’un modèle original qui sera comme le suggèrent les auteurs probablement affiné par de nouvelles données.
[hr]Safety and efficacy of ustekinumab or golimumab in patients with chronic sarcoidosis
MA Judson et al. Eur Respir Journal 2014;44:1296-1307
Editorial par DR Moller
Negative clinical trials in sarcoidosis : failed therapies or flawed study design ?
Par le Docteur Fleur COHEN AUBART, Service de Médecine Interne, Institut E3M, Hôpital Pitié-Salpêtrière, Paris
Judson et al. rapportent les résultats d’un essai de phase II multicentrique randomisé en double aveugle versus placebo à 3 bras visant à évaluer la tolérance et l’efficacité de 2 biothérapies par voie sous-cutanée : l’ustekinumab (un anti IL12-IL23) et du golimumab (un antiTNF-alpha) chez les patients ayant une sarcoïdose pulmonaire et cutanée.
Cent soixante treize patients étaient inclus dans l’étude et randomisés dans un ratio 1 :1 :1 (51 % d’hommes et une majorité, 61 %, de caucasiens). La durée de traitement était de 24 semaines, le critère principal (pourcentage de variation de la capacité vitale forcée) étant évalué à 16 semaines et d’autres critères secondaires à 28 semaines. La corticothérapie orale n’était pas modifiée jusqu’à la semaine 16. Une surveillance était maintenue jusqu’à 44 semaines.
Parmi les 173 patients, 17 sortaient de l’étude avant la fin du traitement sous-cutané (W24) et 15 autres avant la fin du suivi (W44).
Aucun différence statistiquement significative n’était observée à 16 semaines dans les groupes recevant l’ustekinumab ou le golimumab versus placebo (p = 0.12 et 0.5 respectivement). A 28 semaines, aucun des 2 traitements ne montrait d’amélioration par rapport au placebo dans aucun des critères secondaires utilisés (capacité vitale, test de marche des 6 minutes, échelle de dyspnée, ni sur la peau avec le score évalué par le physicien en aveugle du traitement).
Des effets indésirables étaient rapportés dans 15.5 %, 12.7 % et 16.7 % respectivement des bras placebo, golimumab et ustekinumab, dont 4 pneumopathies (1 dans le groupe golimumab, 3 dans le groupe ustekinumab) et un cas de tuberculose sous golimumab.
Dans l’éditorial qui accompagne le rapport de cet essai prospectif, DR Moller exprime la déception que ces résultats apportent, tant le rationnel pour utiliser des antiTNF-alpha ou un antiIL12-Il23 dans la sarcoïdose est fort. Il rappelle qu’un large essai utilisant l’infliximab dans les sarcoïdoses pulmonaires (Baughman et al 2006) n’avait démontré qu’un très modeste bénéfice de 2.5 % de capacité vitale forcée sous infliximab et qu’aucun des critères de jugement secondaires n’était significativement amélioré à 6 mois de traitement versus placebo.
Il existe très peu d’essais prospectifs randomisés dans la sarcoïdose.
DR Moller rappelle quelques éléments du traitement de la sarcoïdose. Les corticoïdes sont des médicaments très efficaces dans cette maladie sur le court et long terme, avec un seuil qui diffère d’un patient à l’autre et selon les organes et des effets indésirables importants sur le long terme. Dans les atteintes pulmonaires, le seuil de corticothérapie pour maintenir une rémission est de l’ordre de 5 à 15 milligrammes par jour (plutôt 10 à 15), 10 à 20 pour les atteintes cardiaques et neurologiques, cette dose minimale pouvant varier dans le temps. La fibrose est en revanche irréversible et peut être responsable de la persistance de symptômes. Les rechutes surviennent généralement lorsqu’on baisse la corticothérapie en dessous de ce seuil minimal et de façon assez lente, l’inflammation granulomateuse se développant en plusieurs semaines voire mois. Enfin, l’utilisation de médicaments immunomodulateurs associés à la corticothérapie permettent de réduire le seuil minimal d’utilisation de celle-ci chez certains patients.
Dans l’essai rapporté par Judson et al. et celui de Baughman sur l’infliximab en 2006, les patients inclus étaient stables depuis au moins un mois sous un seuil de corticothérapie de l’ordre de 15 à 20 milligrammes par jour.
Pour démontrer une efficacité du traitement actif en plus de cette corticothérapie, il aurait fallu que la biothérapie apporte un bénéfice supplémentaire à la corticothérapie ou que les patients sous corticoïdes et placebo dégradent leur fonction respiratoire. Mais ces deux hypothèses de départ étaient probablement fausses : il n’y a aucun rationnel pour penser que le traitement immunosuppresseur ait une efficacité supérieure à celle de la corticothérapie maintenue au dessus de son seuil minimal. Par ailleurs, une corticothérapie supérieure à ce seuil minimal de l’ordre de 10-15 milligrammes par jour est suffisante pour que la fonction respiratoire ne se détériore pas. Ces hypothèses se basaient peut-être sur le fait que la sarcoïdose pulmonaire chronique peut présenter des exacerbations aiguës comme les fibroses pulmonaires idiopathiques. Mais comme dit précédemment, les granulomes mettent des mois à se développer et la plupart des aggravations respiratoires aiguës au cours de la sarcoïdose sont dues à d’autres causes (par exemple infectieuses).
Il est probable qu’une corticothérapie maintenue au dessus du seuil minimal masquera une potentiel efficacité de n’importe quel immunosuppresseur / immunomodulateur dans la sarcoïdose.
Des traitements autres que la corticothérapie sont vivement souhaités dans la sarcoïdose qui est une maladie chronique. DR Moller suggère que pour tester l’intérêt d’épargne cortisonique d’un immunomodulateur, une décroissance rapide de la corticothérapie jusqu’à 5 milligrammes devrait être appliquée.
Au total, cet essai prospectif et randomisé, s’il est décevant par ses résultats, nous rappelle néanmoins la nécessité de procéder à des essais prospectifs de qualité dans le domaine de la sarcoïdose, dont le design devra être mûrement réfléchi afin de pouvoir mettre en évidence le bénéfice potentiel des traitements associés.