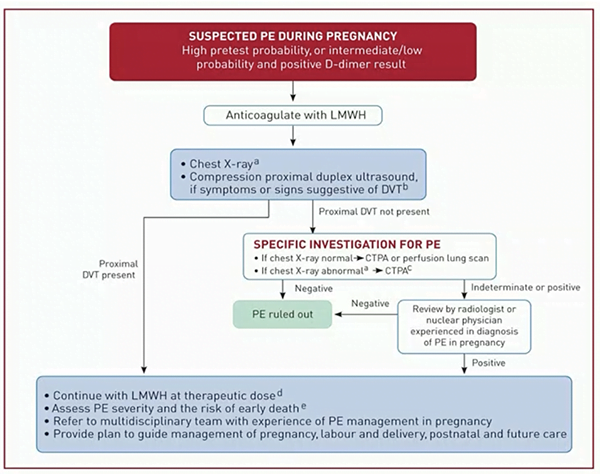
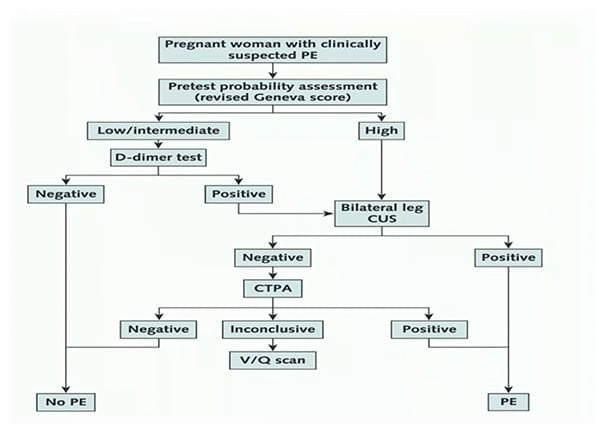
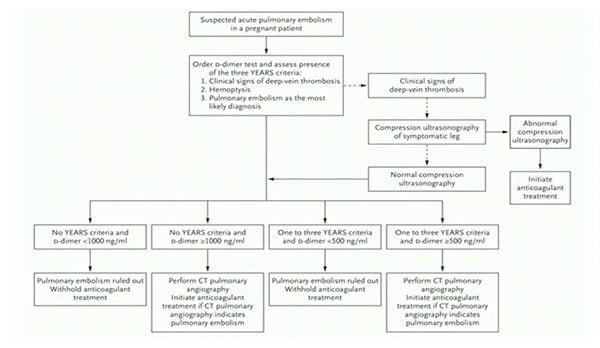
Tézépelumab dans l’asthme sévère, qu’avons-nous appris de plus pendant cet ERS ?

Le tézépelumab, dont l’AMM française n’est pas encore connue, a montré son bénéfice sur la réduction des exacerbations et l’amélioration du contrôle de l’asthme indépendamment d’un phénotype particulier. Plusieurs sessions de l’ERS se sont intéressées à ses résultats récents d’efficacité et de sécurité.
Tels des enfants trépignant d’impatience dans l’attente du Noël à venir, les asthmologues s’enthousiasment de la disponibilité prochaine en France du tézépelumab, nouvelle arme de l’arsenal thérapeutique de l’asthme sévère. Malgré un éventail riche de 4 biothérapies, certains patients restent mal contrôlés ou non éligibles, et cet anticorps anti-TSLP représente un espoir pour les patients asthmatiques non-T2 (si tant est qu’ils existent, mais c’est un autre débat) et les patients T2 en échec des biothérapies existantes.
Des données post-hoc complémentaires des essais NAVIGATOR (phase 3) et PATHWAY (phase 2), ainsi que des données d’extension de l’essai DESTINATION, ont été présentées dans plusieurs sessions distinctes lors de cet ERS. Pas de révolution donc, mais on précise et on fignole petit à petit la connaissance de ce nouveau médicament.
Comparé au placebo après 52 semaines de traitement, le tézépelumab réduit le taux annualisé d’exacerbation d’asthme de 49-50% chez les patients non corticodépendants, et ce, indépendamment de leur taux d’éosinophiles à l’inclusion.
Deux ans après initiation, et toujours contre placebo, la réduction du taux annualisé d’exacerbation était maintenue avec une diminution de 58% (IC95% [49-65]) et 39% (IC95% [4-62]) respectivement dans les études de phase 3 NAVIGATOR et SOURCE.
La tolérance était bonne avec un taux plus faible d’effets secondaires (49,62 vs 62,66/100 patients-années) et d’effets secondaires sévères (7,85 vs 12,45 / 100 patients année) sous tézépelumab que sous placebo.
Comparativement aux variations saisonnières d’exacerbation d’asthme observées dans le groupe placebo (avec pic hivernal), le tézépelumab réduisait significativement le taux d’exacerbation d’asthme quelle que soit la saison, et indépendamment du taux d’éosinophiles. Le phénotype allergique éventuel de ces patients n’était pas connu.
Enfin, dans un essai de phase 2B exploratoire en double aveugle contrôlé contre placebo (CASCADE), le tézépelumab réduisait le score scanographique de bouchons muqueux (p=0,0007). Parallèlement, la réduction de ce score muqueux était corrélée avec l’amélioration des paramètres fonctionnels VEMS et DEM25-75).
Au total, à 1 et 2 ans de traitement, le tézépelumab confirme son excellent profil de tolérance et son efficacité sur la réduction per-annuelle des exacerbations, quelle que soit l’éosinophilie à l’inclusion, et entraine une amélioration des anomalies scanographiques et de la fonction pulmonaire.
Clairelyne Dupin, Service de pneumologie A, Hôpital Bichat, Paris
D’après les communications :
– OA9002 Late breaking abstract « DESTINATION Tezepelumab long term safety and efficacy versus placebo in patients with severe, uncontrolled asthma », présentée par Andrew Menzies-Gow (Londres, Royaume-Uni); Session 257 « Pearls in airway immunology : from mouse to man » du lundi 5 septembre 2022
– OA3670 « Efficacy of Tezepelumab in patients with severe uncontrolled asthma and low blood eosinophil counts not receiving maintenance oral cortical steroids » présentée par Andrew Menzies-Gow (Londres, Royaume-Uni) ; Session 414 “Recent advances in biological treatments for asthma » du mardi 6 septembre 2022
– RCT4445 “Late Breaking Abstract – Tezepelumab reduces mucus plugging in patients with uncontrolled, moderate-to-severe asthma: the phase 2 CASCADE study” présenté par Christopher E. Brightling (Leicester, Royaume-Unis) ; Session “Clinical trials session: ALERT 4: Asthma and interventional pulmonology” du mardi 6 septembre.
– OA2251 “Effect of tezepelumab on seasonal exacerbations in patients with severe, uncontrolled asthma grouped by blood eosinophil count”, présentée par Andrew Menzies-Gow (Londres, Royaume-Uni); Session 272 “Clinical and translational studies of asthma and COPD: novel mechanisms”
Tézépelumab dans l’asthme sévère, qu’avons-nous appris de plus pendant cet ERS ? Lire la suite »