Dans une Perspective publiée fin juin 2018 dans le NEJM, Seymour, et al pour la Food and Drug Administration (FDA) américaine, détaillent les raisons du retrait de la mise en garde (black box) contre les traitements combinés associant bêta2-mimétiques de longue durée d’action (BDLA) et corticostéroïdes inhalés (CSI) chez les patients asthmatiques.1 Cette mise en garde avait été instaurée en 2003 sur la base de données suggérant que les BDLA étaient associés à des effets secondaires graves, dont des hospitalisations liées à l’asthme, des intubations et des décès.2 . Pour mémoire, ces études avaient été menées à une période où les patients traités par BDLA n’utilisaient pas nécessairement de CSI. La FDA avait requis une mise en garde contre tous les produits contenant des BDLA.
En 2011, la FDA a mandaté les laboratoires AstraZeneca, GlaxoSmithKline, Merck et Novartis pour initier parallèlement des essais cliniques de non-infériorité, prospectifs, contrôlés, randomisés et en double aveugle évaluant la tolérance des thérapies combinées BDLA + CSI comparativement aux CSI seuls (NCT01462344, NCT01475721, NCT01471340, NCT01444430, and NCT01845025). Quatre ont été menés à terme : trois chez les adultes et les adolescents âgés de 12 ans et plus, et un chez les enfants de 4 à 11 ans. Les critères de sélection et de jugement étaient harmonisés pour permettre à un comité indépendant une analyse combinée. Les patients inclus présentaient au moins une exacerbation d’asthme dans l’année écoulée et étaient considérés à risque d’exacerbations supplémentaires, mais avaient un asthme contrôlé. Le critère principal de jugement était un critère composite incluant le décès lié à l’asthme, l’intubation et l’hospitalisation. Dans chaque essai adulte, un échantillon de 11 700 patients permettait d’obtenir une puissance de 90 % pour exclure l’hypothèse nulle — doublement du risque d’effet indésirable grave. Pour l’essai pédiatrique, l’échantillon nécessaire était moindre avec 6 200 enfants inclus.
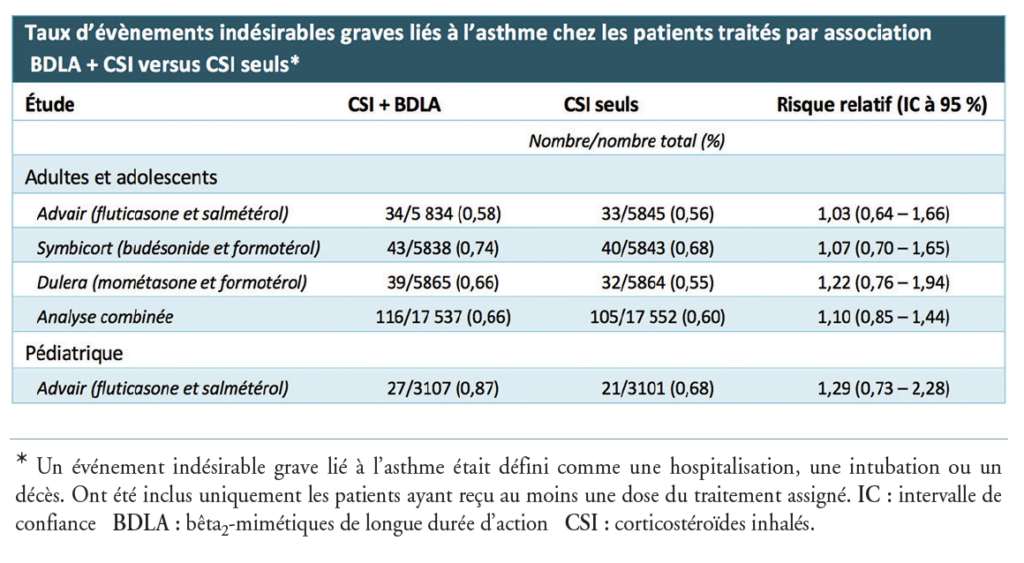
Tableau — Taux d’évènements secondaires graves liés à l’asthme chez des patients traités par BDLA+CSI versus CSI. Traduit de Seymour, et al, NEJM 2018 3
L’analyse combinée des données de tolérance des trois essais adultes, publiée dans la même édition du NEJM, a montré l’absence d’augmentation significative de risque d’évènements indésirables graves liés à l’asthme lors du traitement par BDLA 1 CSI, comparativement au traitement par un CSI seul (risque relatif 5 1,10 [intervalle de confiance à 95 % 5 0,85- 1,44] (cf. tableau). Ces résultats se retrouvaient dans tous les sous-groupes de patients. 4 La majorité des évènements étaient des hospitalisations liées à l’asthme. Il n’a été rapporté que cinq intubations et décès parmi tous les patients inclus dans ces quatre études. L’efficacité de l’association BDLA 1 CSI a également été évaluée. Les trois études d’adultes ont toutes montré une réduction significative du nombre d’exacerbations d’asthme par comparaison aux patients traités par CSI seuls. La réduction portait surtout sur le recours aux corticoïdes systémiques, mais aucune étude n’a démontré de baisse du nombre d’hospitalisations liées à l’asthme.
La FDA souligne que ces résultats ne peuvent pas répondre à tous les questionnements concernant la sécurité d’emploi des BDLA.Par ailleurs, les patients avec un asthme considéré comme « potentiellement mortel » étaient exclus du fait de problématiques éthiques et sécuritaires. Ces résultats ne peuvent donc pas être généralisés à cette population particulière.Malgré ces limitations et incertitudes, ces essais ont apporté des informations solides, nouvelles et rassurantes en termes de sécurité d’emploi et ont démontré les bénéfices additionnels à l’utilisation de thérapies combinées BD
LA + CSI : il n’y a pas de surrisque d’évènements graves liés à l’asthme lors de l’utilisation de thérapies combinées par comparaison aux CSI seuls.Par conséquent, la FDA a choisi de retirer sa mise en garde immédiatement, sans attendre la convocation d’une réunion du comité de validation interne. Le retrait de la mise en garde contre un produit pharmaceutique n’est pas chose commune mais l’évidence dans ce cas était catégorique.
L’association BDLA + CSI, désormais considérée comme le standard de prise en charge du patient asthmatique, est ainsi renforcée et ce retrait de mise en garde permet de légitimer une attitude thérapeutique déjà appliquée. Gardons cependant en mémoire que ces études n’ont pas été conçues pour démontrer la supériorité de l’utilisation des traitements combinés par rapport aux CSI seuls et que les éléments de tolérance ont été relevés sur une période courte de six mois. Elles ne modifient donc pas l’arbre décisionnel du GINA qui place la corticothérapie inhalée seule en premier pallier de traitement du patient asthmatique.
[hr]Clairelyne Dupin
Service de pneumologie A – Hôpital Bichat – APHP Auteur correspondant : clairelyne.dupin@aphp.fr
L’auteur n’a déclaré aucun lien d’intérêt en relation avec cet article. InfoRespiration N°146 – Août-septembre 018
- Seymour SM, Lim R, Xia C, et al. Inhaled corticosteroids and LABAs — Removal of the FDA’s Boxed Warning. N Engl J Med 28 juin 2018 ; 378(26) : 2461‑3. ↩
- Drazen JM, O’Byrne PM. Risks of long-acting beta-agonists in achieving asthma control. N Engl J Med 16 avr 2009 ; 360(16) : 1671‑2 ↩
- Seymour SM, Lim R, Xia C, et al. Inhaled corticosteroids and LABAs — Removal of the FDA’s Boxed Warning. N Engl J Med 28 juin 2018 ; 378(26) : 2461‑3. ↩
- Busse WW, Bateman ED, Caplan AL, et al. Combined analysis of asthma safety trials of long-acting β2-agonists. N Engl J Med 28 2018 ; 378(26) : 2497‑505. ↩